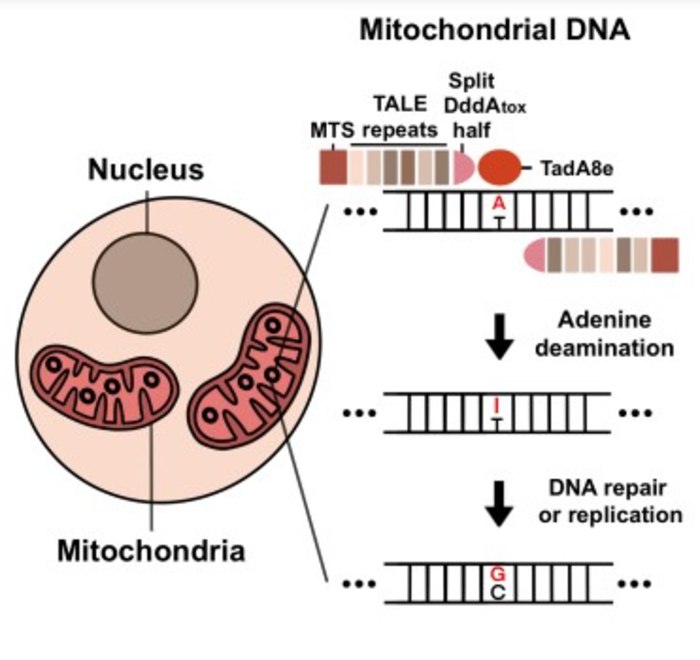
 به گزارش خبرگزای صدا وسیما، به نقل از ستاد توسعه علوم و فناوری سلولهای بنیادی، ویرایشگرهای ژن مورد استفاده در پلتفرم جدید ویرایش ژن میتوکندری TALEDs (دامینازهای مرتبط با عامل شبه فعال کننده رونویسی) نامیده میشوند و دارای سه جزء TALE با طراحی سفارشی (عامل فعال کننده رونویسی) که یک توالی DNA را هدف قرار میدهد. دئوکسی آدنوزین دآمیناز مهندسی شده (TadA۸e) مشتق شده از پروتئین Escherichia coli TadA که A را به G تبدیل میکند، و یک سیتیدین دآمیناز (DddA) که DNA را باز و آن را برای TadA۸e قابل دسترستر میکند.
به گزارش خبرگزای صدا وسیما، به نقل از ستاد توسعه علوم و فناوری سلولهای بنیادی، ویرایشگرهای ژن مورد استفاده در پلتفرم جدید ویرایش ژن میتوکندری TALEDs (دامینازهای مرتبط با عامل شبه فعال کننده رونویسی) نامیده میشوند و دارای سه جزء TALE با طراحی سفارشی (عامل فعال کننده رونویسی) که یک توالی DNA را هدف قرار میدهد. دئوکسی آدنوزین دآمیناز مهندسی شده (TadA۸e) مشتق شده از پروتئین Escherichia coli TadA که A را به G تبدیل میکند، و یک سیتیدین دآمیناز (DddA) که DNA را باز و آن را برای TadA۸e قابل دسترستر میکند.
Sung-Ik Cho، دکترا، نویسنده اول مطالعه جدید، گفت: "ما یک پلتفرم ویرایش ژن جدید به نام TALED ایجاد کردیم که میتواند تبدیل A به G را انجام دهد. ویرایشگر ژن جدید ما به طور چشمگیری دامنه ویرایش ژنوم میتوکندری را گسترش میدهد. این امر میتواند نه تنها در ساخت یک مدل بیماری، بلکه در توسعه یک درمان نیز سهم بزرگی داشته باشد.
جزئیات پلتفرم جدید ویرایش mtDNA در مجله Cell منتشر شد. این یک مطالعه جالب است که ابزارهای ویرایش ژنوم را با دآمینازهای مرتبط با TALE برای جهشهای دقیق A-to-G گسترش میدهد. این مفهوم در DNA میتوکندری انسان با کارایی بالا که امکان پیدایش مدلهای بیماری را فراهم میکند، دلگرم کننده است. در حالی که نیاز به بهینه سازی اختصاصیت در کاربردهای بالینی وجود دارد، این رخداد در واقع گسترش جعبه ابزار ویرایش ژنوم برای مجموعهای از کاربردهای متفاوت در DNA میتوکندری، با پتانسیل بالقوه در سلولهای پستانداران و فراتر از آن است.
توانایی تغییر کد ژنومی با اکتشاف آنزیمهای محدود کننده در سال ۱۹۶۸، واکنش زنجیرهای پلیمراز در سال ۱۹۸۵، نوکلئازهای انگشت روی در سال ۱۹۹۶، برهمکنشهای DNA-افکتور TAL در سال ۲۰۰۹، ویرایش ژن CRISPR-Cas۹ و ویرایش جفت باز در سال ۲۰۱۲ به تدریج افزایش یافته است. در سال ۲۰۱۶. این اکتشافات امکان درمان بیماریهای ژنتیکی که قبلاً صعب العلاج بودند را با ویرایش جهشهای بیماری زا در ژنوم انسان ممکن ساخته است. با این حال، ابزارهای ویرایش ژنوم سلول زنده تا حد زیادی بر روی ژنوم هستهای متمرکز شده اند.
جهش در DNA حلقوی میتوکندری (mtDNA) که از مادر به ارث میرسد، مسئول چندین بیماری شدید است. ۹۰ جهش نقطهای بیماری زا در mtDNA وجود دارد که از هر ۵۰۰۰ نفر حداقل ۱ نفر را تحت تاثیر قرار میدهد.
برخی از بیماریهای ارثی شدید به دلیل نقص در mtDNA ایجاد میشوند. به عنوان مثال، نوروپاتی بینایی ارثی لبر (LHON)، که باعث کوری ناگهانی در هر دو چشم میشود، توسط یک جهش ساده تک نقطهای در mtDNA ایجاد میشود.
علاوه بر این، MELAS (آنسفالومیوپاتی میتوکندری با اسیدوز لاکتیک و دورههای مشابه سکته مغزی) به تدریج به مغز بیمار حمله میکند. مطالعات دیگر نشان میدهد که ناهنجاریهای mtDNA ممکن است مسئول بیماریهای دژنراتیو مانند بیماری آلزایمر و دیستروفی عضلانی نیز باشد.
ابزارهای ویرایش ژنوم موجود را نمیتوان برای ویرایش mtDNA به دلیل محدودیت در روشهای انتقال به سلول استفاده کرد. به عنوان مثال، RNAهای راهنمای استفاده شده در پلتفرم CRISPR-Cas قادر به ورود به میتوکندری نیستند.
مشکل دیگر این است که کمبود مدلهای حیوانی برای این بیماریهای میتوکندریایی وجود دارد. این مسئله به این دلیل است که در حال حاضر امکان مهندسی جهشهای میتوکندریایی لازم برای ایجاد مدلهای حیوانی وجود ندارد.» از سوی دیگر فقدان مدلهای حیوانی، توسعه و آزمایش روشهای درمانی برای این بیماریها را بسیار دشوارتر میکند.
با کشف ویرایشگرهای جفت باز سیتوزینی مشتق از DddA (DdCBEs) در سال ۲۰۲۰ توسط تیمی به سرپرستی دیوید لیو، استاد انستیتوی برود هاروارد و MIT، و جوزف موگوس، استاد دانشگاه واشنگتن، مشخص شد که امکان انجام تبدیل سیتوزین (C) به تیمین (T) در mtDNA بدون ایجاد شکستهای DNA دو رشتهای وجود دارد. با این حال، DdCBEs تا حد زیادی به تبدیل C-به-T در موتیف TC محدود شده و میتوانست تنها حدود ۱۰ ٪ جهشهای نقطه میتوکندری بیماری زا را اصلاح کند.
لیو، که در مطالعه فعلی شرکت نداشته است، به پایگاه خبری گفت: جین سو و گروهش به زیبایی نشان دادند که چگونه ادغام ویرایشگر جفت باز سیتوزین میتوکندری و آنزیم دآمینازی که برای ویرایشگرهای جفت باز آدنین هستهای خود تکامل دادهایم، میتواند به هدف مهم ویرایش جفت باز آدنین در DNA میتوکندری منجر شود. اگرچه جهش در DNA میتوکندری باعث بسیاری از بیماریهای ژنتیکی جدی میشود، میتوکندریها قبلاً به دلیل دشواری تحویل RNAهای راهنمای CRISPR به داخل میتوکندری در برابر ویرایش دقیق ژن مقاومت داشتند.
نویسندگان گزارش کردند که TALEDهای طراحی شده سفارشی، A را به طور موثر در سلولهای انسانی در ۱۷ هدف در ژنهای مختلف میتوکندری با فرکانس ویرایش ۴۹ درصدی تبدیل کرده اند.
علاوه بر این، TALED هیچ سمیت سلولی نشان نداد و یکپارچگی mtDNA را حفظ کرد. TALEDها هیچ ویرایش نامطلوب خارج از هدف در DNA هستهای ایجاد نکردند و تنها اثرات خارج از هدف بسیار کمی در mtDNA. داشتند.
در مطالعات آتی، محققان قصد دارند با افزایش کارایی و اختصاصیت ویرایش TALEDها را بهبود بخشند تا راه را برای کاربرد این فناوری در بیماران هموار کنند. این تیم همچنین در حال توسعه TALEDهای مناسب برای ویرایش پایه A-to-G در DNA کلروپلاست هستند.









